- HÉMATOPOÏÈSE
- HÉMATOPOÏÈSEL’hématopoïèse – dont le nom signifie «production du sang» – est la fonction par laquelle l’organisme produit et renouvelle les éléments figurés du sang, c’est-à-dire les globules rouges, les globules blancs et les plaquettes. C’est l’un des exemples les plus remarquables, probablement le mieux connu, de l’aptitude des organismes supérieurs à renouveler les différents tissus qui les composent. On connaît assez précisément la durée de vie des cellules hématopoïétiques différenciées et leur nombre. Cela permet d’estimer leur taux de renouvellement. Pour les globules rouges, dont la durée de vie est relativement longue (120 jours en moyenne) mais dont le nombre est de 5 millions par millimètre cube de sang normal, 200 憐 109 cellules nouvelles environ doivent être produites chaque jour. Pour les polynucléaires neutrophiles, dont la durée de vie est beaucoup plus brève (environ 24 h) et le nombre également beaucoup plus faible (5 000/mm3 de sang), les besoins sont moindres, de l’ordre de 1010 cellules à produire chaque heure. Comme dans tous les tissus à taux élevé de renouvellement (peau, intestin grêle, muqueuse), les phénomènes qui gouvernent la prolifération et la différenciation des cellules hématopoïétiques résultent de régulations quantitatives et qualitatives très fines. Pour maintenir pendant toute la durée de la vie humaine un taux aussi élevé de renouvellement cellulaire, il est indispensable de pouvoir en permanence puiser dans une réserve de cellules dites souches.Ces cellules souches ont par nécessité deux propriétés essentielles, que l’on ne rencontre pas à des stades ultérieurs de la différenciation: elles sont capables de s’autorenouveler, ce qui permet le maintien d’un nombre constant de cellules souches; elles sont capables de se différencier pour assurer le renouvellement des cellules qui meurent physiologiquement (et même assurer un renouvellement encore plus rapide en cas d’accroissement des besoins).Au sein de l’hématopoïèse, on distingue la myélopoïèse, qui est la production des cellules myéloïdes (globules rouges, polynucléaires, monocytes, plaquettes), et la lymphopoïèse, qui est la production des cellules lymphoïdes.La régulation de l’hématopoïèse est sous le contrôle de nombreux facteurs stimulants et inhibiteurs. Les progrès dans la connaissance de ces facteurs ont déjà permis de purifier plusieurs d’entre eux qui peuvent être maintenant obtenus par clonage moléculaire.1. La myélopoïèseGrandes étapes de la myélopoïèsePendant longtemps, les chercheurs et les médecins n’ont connu de l’hématopoïèse que ce qu’ils pouvaient en voir au microscope, c’est-à-dire les cellules les plus différenciées du sang et de la moelle. L’existence de cellules souches, êtres de raison, intellectuellement indispensables pour expliquer le renouvellement cellulaire, ne fut prouvée que bien plus tard grâce à des expériences de greffes après irradiation mortelle, dite létale, réalisée chez l’animal. Ensuite, ces cellules souches ont pu être cultivées in vitro pendant des semaines.Les cellules différenciées de la moelle sont en revanche facilement reconnaissables au microscope grâce aux protéines spécialisées ou aux organites particuliers de leur cytoplasme. Ainsi les futurs globules rouges ou érythroblastes sont caractérisés par la production de l’hémoglobine ; les différentes cellules granuleuses par leurs granulations ou lysosomes, comme il en est pour les mégacaryocytes, dont le cytoplasme va se fragmenter pour donner naissance aux plaquettes. Entre les cellules souches et les cellules différenciées se place une étape essentielle et complexe dont l’existence a été longtemps méconnue: celle des cellules en voie de différenciation, appelées aussi progéniteurs (en anglais: committed stem cells ). La preuve de l’existence de cellules hématopoïétiques intermédiaires entre les cellules souches et les cellules reconnaissables dans la moelle a été apportée depuis une trentaine d’années par les techniques de culture en milieu dit semi-solide. Des colonies de cellules s’y développent à partir d’une seule cellule immobilisée dans le milieu de culture.Ces progéniteurs ont deux particularités:– Ils subissent de très nombreuses divisions (une vingtaine) entre la cellule souche qui leur a donné naissance et la différenciation définitive. Cela montre que c’est à ce niveau que se fait l’essentiel de la production, puisque les cellules différenciées ne subiront que quatre divisions environ avant de quitter la moelle.– Ils subissent une différenciation progressive qui va, d’une cellule souche totipotente, aboutir à des cellules irréversiblement destinées à se différencier vers une lignée myéloïde particulière (érythroïde, granuleuse, mégacaryocytaire...).Le tableau ci-après montrant les principales caractéristiques des cellules dans ces différentes étapes de la myélopoïèse permet de constater d’abord que le pourcentage de cellules «en cycle» [cf. DIVISION CELLULAIRE] augmente de façon assez régulière au fur et à mesure que l’on se rapproche de la différenciation définitive et, ensuite, que l’on trouve dans le sang des cellules souches stricto sensu, des progéniteurs et les cellules qui ont terminé leur différenciation. Normalement, les cellules en cours de différenciation définitive ne sont retrouvées qu’au niveau de la moelle, exclusivement.Les cellules souchesLes études faites in vivo chez la souris ont permis de démontrer que les cellules souches myéloïdes sont totipotentes, c’est-à-dire qu’une seule cellule souche va pouvoir donner naissance à des globules rouges, des polynucléaires éosinophiles, des monocytes, des mégacaryocytes. Cette notion débouche en pathologie sur la notion de clone. On appelle clone de cellules myéloïdes toutes les cellules dérivées d’une même cellule souche totipotente. Beaucoup de maladies malignes hématologiques débutent au niveau d’une cellule souche dont les descendants vont exprimer la maladie. Les cellules souches chez la souris et chez l’homme, le plus souvent, ne sont pas en cycle cellulaire (phase dite G zéro). Cela explique qu’elles soient relativement à l’abri des effets toxiques des radiations et des chimiothérapies, comme le montre la régénération complète d’une moelle apparemment «déserte» à la suite d’un traitement par chimiothérapie ou radiothérapie à des doses non létales. La relation entre cellule souche myéloïde et cellule souche lymphoïde est relativement étroite: les cellules souches lymphoïdes T étant individualisées antérieurement à la genèse des cellules souches lymphoïdes B et des cellules souches myéloïdes. On explique ainsi que les cellules B fassent volontiers partie du même clone de cellules malignes que les cellules myéloïdes, alors que les cellules T peuvent y être étrangères. Comme on l’a vu, les cellules souches sont surtout nombreuses dans la moelle; mais on en trouve également dans la circulation, et cela explique probablement l’homogénéité des maladies malignes du tissu myéloïde, qui sont pratiquement toujours disséminées d’emblée à l’ensemble de la moelle.La régulation de la production des cellules souches est encore pour l’essentiel inconnue. Il existe très vraisemblablement des facteurs de régulation hormonaux; probablement il y a également des régulations de cellule à cellule. On ne sait pas non plus comment se maintient constant le nombre de cellules souches dans l’organisme, mais on invoque deux hypothèses: celle des mitoses hétérotypiques, où une cellule souche va donner naissance à deux cellules filles, l’une qui se différencie, l’autre qui reconstitue le pool des cellules souches totipotentes; celle de deux mitoses homotypiques: la première donne naissance à deux cellules filles qui vont entrer dans la différenciation et la seconde à deux cellules souches totipotentes.Les progéniteursLes progéniteurs sont caractérisés par l’acquisition progressive d’une différenciation fonctionnelle qui ne se manifeste par aucun caractère cytoplasmique cytologiquement décelable. Cette différenciation se manifeste essentiellement par la perte progressive des potentialités jusqu’à la spécialisation dans une seule lignée. Ces progéniteurs sont identiques par les colonies qu’ils forment in vitro. La terminologie anglo-saxonne de CFU (pour colony forming unit ) est généralement utilisée pour les désigner. Les progéniteurs les plus proches des cellules souches totipotentes sont eux-mêmes multipotents, mais ils n’ont plus la faculté d’autorenouvellement prolongé.Ces précurseurs multipotents sont généralement désignés sous le terme de CFU-GEMMk (granuleux, érythroïde, monocytaire, mégacaryocytaire). On trouve cependant également dans ces colonies des éosinophiles et des lymphocytes B, voire T. Ces CFU-GEMMk, en perdant une partie de leurs potentialités, deviennent des progéniteurs bipotents, par exemple E + M ou E + G (fig. 1). Les cellules qui restent le plus tardivement bipotentes sont les CFU-GM, précurseurs communs aux granulocytes et aux monocytes. Les mécanismes de cette différenciation progressive sont de mieux en mieux connus. Chez la souris comme chez l’homme, on a pu montrer qu’il n’y a pas de prédétermination génétique du devenir de ces cellules et que la différenciation n’est régie que par les lois du hasard (phénomène dit stochastique). Il est probable que ce hasard dépend de l’acquisition et de la perte par ces cellules de récepteurs spécifiques pour les facteurs de croissance exogènes. C’est pourquoi la teneur médullaire ou sanguine en facteurs de croissance permettra la régulation du nombre des cellules en fonction des besoins. Ces facteurs de croissance, après avoir été identifiés biologiquement, essentiellement grâce aux cultures in vitro, ont été purifiés, et les gènes qui codent plusieurs d’entre eux ont maintenant été clonés. Les facteurs de croissance des cellules myéloïdes, bien identifiés, sont l’interleukine 3 (IL 3), le GM-CSF (CSF signifie colony stimulating factor ), le M-CSF, le G-CSF et l’érythropoïétine. L’IL 3 agit à un stade un peu plus précoce que le GM-CSF mais favorise aussi la formation des mastocytes. Un facteur actif à un stade encore plus précoce a été identifié en 1990: le stem cell factor . Ce facteur agit synergétiquement avec tous les autres facteurs de croissance (fig. 2). Dans la lignée rouge, l’effet de l’IL 3 s’arrête au niveau de la CFU-E, et un autre facteur de croissance, l’érythroïétine, est indispensable pour la différenciation définitive en érythroblastes. Dans les lignées granuleuses, l’IL 3 suffit à induire une différenciation définitive en granuleux ou en monocytes mais moins efficacement que le GM-CSF. Les facteurs de croissance spécifiques (M-CSF pour les monocytes, G-CSF pour les granuleux) augmentent cependant le nombre de colonies respectivement monocytaires et granuleuses. Il existe donc, comme le montre la figure 3, une asymétrie entre la lignée érythroblastique et les lignées granulo-monocytaires. L’IL 3, l’IL 6 jouent un rôle, mais il existe certainement un facteur spécifique de cette liguée qui reste à déterminer. L’érythropoïétine favorise la différenciation terminale des plaquettes. Pour les éosinophiles, c’est l’IL 5 qui semble être le facteur essentiel de stimulation.Les facteurs de croissance de la lignée mégacaryocyto-plaquettaire sont relativement moins bien connus. Chez la souris, l’IL 3 permet la différenciation des progéniteurs multipotents en mégacaryocytes, mais d’autres facteurs plus spécifiques interviennent certainement. L’IL 3 permet également, chez la souris du moins, la différenciation des mastocytes. Les facteurs de différenciation spécifiques de la lignée éosinophile reste à identifier plus précisément et l’équivalent humain de l’interleukine 3 demeure à identifier.La différenciation myéloïde terminaleLa dernière étape du processus est la différenciation myéloïde. La multiplication nucléaire et cellulaire (seulement nucléaire dans le cas des mégacaryocytes) et la différenciation restent associées et synchronisées durant les quatre divisions qui surviennent, en moyenne, à cette étape. La différenciation se poursuit ensuite sans division nucléaire ni cellulaire; c’est ce que l’on appelle souvent la maturation.Cas de la lignée rouge: l’érythropoïèseLa lignée rouge est constituée des cellules formatrices des globules rouges, ou érythroblastes, dont la caractéristique fondamentale est de produire l’hémoglobine qui joue un rôle essentiel dans les échanges respiratoires.L’aspect morphologique des érythroblastes permet leur classification, fondée sur le volume de leur noyau, l’aspect de leur chromatine et la coloration du cytoplasme par les colorants usuels (cf. planche couleurs). Dans l’ensemble, au fur et à mesure des mitoses, le volume de la cellule et celui du noyau diminuent. La chromatine se condense progressivement jusqu’à l’expulsion du noyau, le cytoplasme s’enrichit en hémoglobine et s’appauvrit en ARN-messagers et passe donc d’une couleur bleue (basophilie) à une couleur orange (acidophilie), les érythroblastes intermédiaires auront ainsi un cytoplasme «polychromatophile».Le proérythroblaste est une cellule de grande taille (de 15 à 20 猪m), à rapport nucléocytoplasmique élevé, avec un noyau rond dont la chromatine est régulière. Le cytoplasme est très riche en ribosomes et en polyribosomes, avec de nombreuses mitochondries. L’érythroblaste basophile I , plus petit, a un rapport nucléo-cytoplasmique moins élevé. La chromatine se rassemble au contact de la membrane nucléaire. La densité ribosomale diminue. Dans l’érythroblaste basophile II , la chromatine s’est condensée en motte, l’espace périnucléaire est large et les pores de la membrane nucléaire évidents; le cytoplasme dense contient moins de ribosomes et moins de mitochondries. Au stade polychromatophile , le noyau est tout entier occupé par de gros amas chromatiniens, le cytoplasme continue à s’appauvrir en ribosomes; les mitoses cessent à ce stade. Au stade acidophile , le noyau est pycnotique (résiduel) et se déplace vers la périphérie de la cellule où il s’isole du cytoplasme par coalescence de petites vésicules.Le réticulocyte est un érythroblaste acidophile qui vient d’expulser son noyau. La synthèse des ARN-messagers a cessé, mais il reste des ARN résiduels dont la disparition distingue le globule rouge mature du réticulocyte.Les phénomènes de régulation de l’érythropoïèse sont ceux que l’on connaît le mieux. Le rôle essentiel des globules rouges est en effet le transport de l’oxygène aux tissus. C’est la concentration en oxygène, probablement au niveau du rein, qui déclenche la production de l’érythropoïétine (par des cellules qui sont situées dans la région des tubules rénaux). L’augmentation de la concentration en érythropoïétine accroît le nombre des CFU-E et surtout entraîne la différenciation des CFU-E en érythroblastes. En l’absence d’érythropoïétine, les CFU-E meurent. L’érythropoïétine induit dans les CFU-E l’ensemble des phénomènes qui précèdent la synthèse des protéines caractéristiques de la lignée rouge, et en particulier la synthèse de l’hémoglobine.On a évalué la cinétique de l’érythropoïèse grâce à la richesse en hémoglobine des érythroblastes en mesurant l’incorporation de fer radioactif par les cellules érythroblastiques. La durée totale de l’érythropoïèse entre le proérythroblaste et la sortie du réticulocyte est d’environ sept jours, dont quatre jours pour la phase de multiplication et environ trois jours pour la phase de maturation.Cas de la lignée granuleuse: la granulopoïèseComme on l’a vu ci-dessus, les polynucléaires neutrophiles et les monocytes sont des cellules très proches, alors que les polynucléaires éosinophiles et les polynucléaires basophiles sont des cousins plus éloignés. La terminologie, liée à l’aspect morphologique du noyau, est donc trompeuse.L’aspect cytologique est dominé par l’élaboration des granulations ou lysosomes par des cellules granuleuses en voie de différenciation dans le cytoplasme. Les lysosomes ainsi élaborés ont un rôle essentiel dans la fonction des lignées granuleuses après la phagocytose. Ce sont eux qui donnent leur spécificité aux différentes lignées neutrophile, monocyte, basophile, éosinophile.Dans la lignée neutrophile, les granules du myéloblaste sont formées à partir de la face concave des citernes de l’appareil de Golgi; ce sont des granulations primaires, dites azurophiles, riches en peroxydase, arysulfatase et phosphatases acides. Au stade promyélocyte, la production des granulations primaires cesse, pour faire place à celle des granulations secondaires, dites spécifiques, qui durera pendant tout le stade myélocyte.Dans la lignée éosinophile, les granulations passent par deux stades: immature, homogène, et ensuite mature, contenant un cristal central aux contours angulaires. Les granulations basophiles ont également en leur centre un cristal. Elles contiennent histamine et héparine.La cinétique dans la lignée granuleuse neutrophile est assez bien connue. On y individualise trois compartiments: un compartiment de multiplication et de différenciation, qui comprend les stades myéloblaste, promyélocyte et myélocyte; un compartiment de maturation sans multiplication, incluant métamyélocytes et polynucléaires médullaires; un compartiment périphérique limité aux polynucléaires matures. La durée de séjour intramédullaire depuis le myéloblaste jusqu’au polynucléaire neutrophile est d’environ 10 jours. La régulation de la granulopoïèse est complexe. L’interleukine 3, le GM-CSF, le M-CSF et le G-CSF interviennent en se complétant. Dans la lignée monocytaire, le temps de séjour médullaire est plus bref que dans la lignée granuleuse. les monocytes, cellules apparemment les plus matures de cette lignée au niveau de la moelle et du sang, vont passer dans les tissus où elles vont pouvoir continuer à se diviser, donnant naissance aux macrophages tissulaires, étape ultime de la différenciation de cette lignée.Cas de la lignée mégacaryocytaire et plaquettaireLes thrombocytes ou plaquettes sont formés dans la moelle osseuse par des mégacaryocytes. Ces derniers sont facilement reconnaissables à cause de leur grande taille. On distingue, par stade successif de différenciation, les mégacaryoblastes, les mégacaryocytes basophiles, les mégacaryocytes granuleux, dont le cytoplasme se fragmente en amas de plaquettes. Les mégacaryocytes se divisent au niveau de leur noyau sans division cellulaire. De ce fait, la chromatine du noyau augmente progressivement de N jusqu’à 32 N ou 64 N. De la quantité d’ADN dépendrait la taille finale du cytoplasme et donc le nombre de plaquettes produit. La régulation de la mégacaryocytopoïèse est actuellement la plus mal connue des lignées myéloïdes.Évolution de la myélopoïèse au cours de la viePendant la période embryonnaire, on distingue trois phases correspondant chacune approximativement à un trimestre. La première phase est mésoblastique. Elle est quasi exclusivement érythroblastique. Elle débute à la fin du premier mois et se poursuit jusqu’au troisième mois; elle est essentiellement intravasculaire. La deuxième phase a lieu dans le foie et la rate; elle est donc hépatosplénique, en fait essentiellement hépatique. À partir du sixième mois, l’hématopoïèse médullaire (qui débute vers le 4e ou le 5e mois) devient plus importante que l’hématopoïèse hépatique, qui régresse régulièrement jusqu’à la naissance.À la naissance, l’hématopoïèse est donc quasi exclusivement médullaire. Elle se fait dans tous les os, y compris le crâne et les phalanges. La moelle est, à cet âge, presque entièrement hématopoïétique, avec très peu de cellules graisseuses.Durant la croissance, on assiste à deux changements: une régression «centripète» de l’hématopoïèse, qui, chez l’adulte, se limite aux ceintures osseuses (scapulaire et pelvienne), aux côtes et au rachis, une modification de la proportion des cellules graisseuses et des cellules hématopoïétiques, qui se partageront normalement la moelle de l’adulte à raison de 50 p. 100 environ pour chacune de ces catégories.Chez le sujet âgé, la richesse médullaire décroît progressivement, surtout après soixante-dix ans. Cela n’entraîne cependant pas de diminution physiologique du nombre de cellules sanguines circulantes. La traduction est essentiellement fonctionnelle, avec diminution des capacités de récupération après une agression toxique comme une chimiothérapie antinéoplasique. Il est certain que, normalement, le nombre de cellules souches est suffisant pour assurer le maintien d’une myélopoïèse normale, même à des âges très avancés. Il n’y a donc pas d’aplasie physiologique du sujet âgé.2. La lymphopoïèseLes lymphocytes sont mêlés aux cellules myéloïdes dans le sang et dans la moelle. Dans le sang, ils sont classiquement comptés avec les globules blancs, ou leucocytes, bien qu’ils en soient physiologiquement plus éloignés que les plaquettes ou les globules rouges. On a vu que les cellules souches lymphoïdes et myéloïdes sont cousines, et qu’il existe certainement, même chez l’adulte, des cellules souches qui gardent une double potentialité lymphoïde et myéloïde.La lymphopoïèse est, comme la myélopoïèse, caractérisée par des étapes de différenciation successives. La différenciation des cellules lymphoïdes est, dans une certaine mesure, beaucoup mieux connue que leur multiplication. Par rapport aux cellules myéloïdes, les cellules lymphoïdes sont en effet physiologiquement caractérisées par l’importance des échanges intercellulaires. Ces échanges, appelés aussi coopération, nécessitent la présence à la membrane cellulaire de molécules spécifiques. Ces molécules sont antigéniques, et les anticorps monoclonaux ont permis de décrire toute une série de molécules membranaires dont l’apparition ou la disparition caractérise une étape de la différenciation lymphoïde. Une première différenciation très précoce se fait entre la cellule lymphoïde B (qui va, au terme de sa maturation, fabriquer des anticorps) et la cellule lymphoïde T. La désignation B vient de la «bourse de Fabricius», qui est l’organe de production des cellules lymphoïdes B chez les oiseaux. La lettre T vient de thymus, organe de production et de différenciation des cellules lymphoïdes T. Les cellules lymphoïdes B se différencient successivement en lymphoplasmocytes, puis en plasmocytes et sécrètent successivement des immunoglobulines IgD et IgM puis IgG - IgA ou IgE. Les cellules lymphoïdes T se différencient ultérieurement en cellules dites auxiliaires (en anglais: helper ), caractérisées par la molécule de membrane T 4, et cellules T tueuses ou suppressives, caractérisées par la molécule de membrane T 8. Les cellules T 4 jouent un rôle de régulation dans la réponse immune et dans les interactions entre cellules T. Les cellules T 8 peuvent avoir un effet suppresseur sur la réponse immune et les cellules T 8 tueuses ont pour rôle l’élimination de cellules portant des antigènes étrangers, en particulier viraux. Une autre catégorie de cellules T sont les cellules N.K. (pour natural killer ), cellules T primitives dont les fonctions sont mal connues et qui tuent sans stimulus antigénique préalable. On se reportera pour de plus amples détails à l’article système IMMUNITAIRE.Il existe des interactions physiologiques entre lymphocytes et myélopoïèse. En effet, certains lymphocytes, et en particulier les lymphocytes T, jouent un rôle régulateur soit directement par contact intercellulaire, soit indirectement par la production de facteur de croissance comme l’IL 3 et le GM-CSF.
hématopoïèse [ ematopɔjɛz ] n. f.• hématopoèse 1873; du gr. haimatôpoiein, de poiein « faire »♦ Physiol. Formation des cellules sanguines. ⇒ érythropoïèse.
● hématopoïèse ou hémopoïèse nom féminin (grec haimatôpoiein, de poiein, faire) Formation des cellules du sang dans la moelle rouge des os et dans le tissu lymphoïde.hématopoïèsen. f. PHYSIOL Formation des cellules sanguines (hématies, leucocytes, plaquettes), qui s'opère dans la moelle osseuse (et dans les ganglions, pour divers lymphocytes).⇒HÉMATOPOÏÈSE, subst. fém.PHYSIOL. Élaboration des cellules sanguines par les organes qualifiés d'hématopoïétiques. Murray (1932) est arrivé à d'intéressants résultats en cultivant des fragments de la ligne primitive de l'embryon de poulet. L'hématopoïèse apparaît dans les cultures de toute région du blastoderme en arrière du niveau du quart antérieur de la ligne primitive (J. VERNE, Vie cellul., 1937, p. 93).Prononc. : [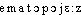 ]. Étymol. et Hist. 1873 hématopoèse médullaire (CH. ROBIN, Anat. et Physiol. cellulaire, Paris, Baillière, p. 573); 1890 hématopoïèse (Lar. 19e suppl.) Dér. du gr.
]. Étymol. et Hist. 1873 hématopoèse médullaire (CH. ROBIN, Anat. et Physiol. cellulaire, Paris, Baillière, p. 573); 1890 hématopoïèse (Lar. 19e suppl.) Dér. du gr. 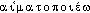 , -
, - « changer en sang » (composé de
« changer en sang » (composé de 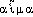 , -
, -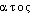 « sang » et de
« sang » et de 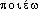 , -
, - « faire ») d'apr.
« faire ») d'apr. 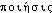 « action de faire, création », dér. de
« action de faire, création », dér. de 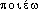 , -
, - « faire ».hématopoïèse [ematopɔjɛz] n. f.ÉTYM. 1888, Larousse; hématopoèse, 1873, Littré-Robin; grec haimatôpoïein, de haima, atos « sang », et poïein « faire ».❖♦ Physiol. Formation des globules sanguins.❖DÉR. Hématopoïétique.
« faire ».hématopoïèse [ematopɔjɛz] n. f.ÉTYM. 1888, Larousse; hématopoèse, 1873, Littré-Robin; grec haimatôpoïein, de haima, atos « sang », et poïein « faire ».❖♦ Physiol. Formation des globules sanguins.❖DÉR. Hématopoïétique.
Encyclopédie Universelle. 2012.
